Globale Biosimilars-Marktgröße, -Anteil und -Trends, COVID-19-Auswirkungsanalysebericht, nach Produkt (rekombinantes menschliches Wachstumshormon (RHGH), Granulozyten-Kolonie-stimulierender Faktor, Interferon und andere), nach Herstellungsart (Eigenherstellung und Auftragsfertigung), nach Technologie (rekombinante DNA und monoklonale Antikörper), nach Anwendung (Offsite-Behandlung, Onkologie, chronische Störung, Autoimmunerkrankung und andere) und nach Region (Nordamerika, Europa, Asien-Pazifik, Lateinamerika, Naher Osten und Afrika), Analyse und Prognose 2021 - 2030
Industrie: HealthcareDer globale Markt für Biosimilars wurde im Jahr 2021 auf 17,6 Milliarden US-Dollar geschätzt. Laut dem neuesten Forschungsbericht von Spherical Insights & Consulting wird der Markt bis 2030 voraussichtlich auf 56,40 Milliarden US-Dollar wachsen, bei einer durchschnittlichen jährlichen Wachstumsrate von 22,80 %.
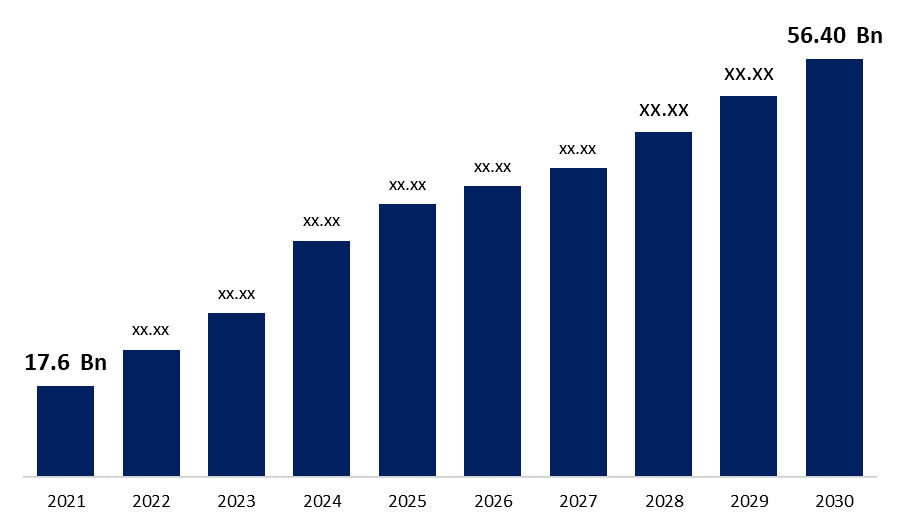
Erfahren Sie mehr über diesen Bericht -
Biosimilars sind Nachahmermedikamente, die bereits zugelassenen biologischen Arzneimitteln (den biologischen Referenzmedikamenten) ähneln, aber nicht identisch sind. Nach den Vorschriften vieler Länder ist ein „ähnliches Biologikum“ ein biologisches Produkt/Arzneimittel, das mithilfe gentechnischer Verfahren hergestellt wurde und in Bezug auf Sicherheit, Wirksamkeit und Qualität als „ähnlich“ einem Referenzbiologikum gilt. Biosimilar-Medikamente haben einen Wirkstoff, der dem eines biologischen Referenzmedikaments ähnelt, und werden zur Behandlung derselben Erkrankung in derselben Dosierung verwendet. Zur Beschreibung von Biosimilars werden Begriffe wie „entitätsbasiert“ (einschließlich Produktprozess), „regulierungsbasiert“ (unter beschleunigten Tests) und „marktbasiert“ verwendet (gleiche Hersteller, anderer Handelsname). Ähnliche biologische Produkte, Nachfolge-Biologika, nachfolgende Biologika, Biologika aus zweiter Hand, Biogenetik, Produkte aus mehreren Quellen und patentfreie Biotech-Produkte sind alles Synonyme für Biosimilars. Die breite Öffentlichkeit und Versicherungsgesellschaften bevorzugen kostengünstige Optionen; die langfristigen wirtschaftlichen Auswirkungen des Einsatzes von Biosimilars wurden jedoch nicht untersucht. Die Gesamtkosten der Biosimilar-Therapie können steigen.
Durchsuchen Sie wichtige Brancheneinblicke auf 196 Seiten mit 119 Marktdatentabellen und Abbildungen und Diagrammen aus dem Bericht „ Globale Marktgröße, Anteil und Trends für Biosimilars, COVID-19-Auswirkungsanalysebericht, nach Produkt (rekombinantes menschliches Wachstumshormon (RHGH), Granulozyten-Kolonie-stimulierender Faktor, Interferon und andere), nach Herstellungstyp (Eigenherstellung und Auftragsfertigung), nach Technologie (rekombinante DNA und monoklonale Antikörper), nach Anwendung (Offsite-Behandlung, Onkologie, chronische Störungen, Autoimmunerkrankungen und andere) und nach Region (Nordamerika, Europa, Asien-Pazifik, Lateinamerika, Naher Osten und Afrika), Analyse und Prognose 2021 – 2030 “
Globaler Biosimilars-Markt Berichterstattung melden
| Berichterstattung melden | Details |
|---|---|
| Basisjahr: | 2021 |
| Marktgröße in 2021: | 17,6 Milliarden USD |
| Prognosezeitraum: | 2021-2030 |
| Prognosezeitraum CAGR 2021-2030 : | 22,80 % |
| 2030 Wertprojektion: | 56,40 Milliarden USD |
| Historische Daten für: | 2017-2020 |
| Anzahl der Seiten: | 231 |
| Tabellen, Diagramme und Abbildungen: | 110 |
| Abgedeckte Segmente: | Nach Produkt, nach Herstellungsart, nach Technologie, nach Anwendung, nach Region |
| Abgedeckte Unternehmen:: | Sandoz, Pfizer, Biocon Limited, Fresenius Kabi AG, Boehringer Ingelheim, Mylan N.V, Organon Group of Companies, Eli Lilly and Company, Teva Pharmaceutical Industries Ltd, Dr. Reddys Laboratories, Amgen Inc, Celltrion, Leo Pharma, MSD, Sanofi, Novartis, Mundipharma, AbbVie, Others |
| Fallstricke und Herausforderungen: | Zunehmende Zulassungen von Biosimilars-Produkten in wichtigen |
Erfahren Sie mehr über diesen Bericht -
Biosimilars sind eine neue Klasse von Medikamenten, die genauso sicher und wirksam sein sollen wie patentfreie Biologika. Aufgrund ihrer aktiven Proteinstruktur lösen Biologika eher eine akute und anhaltende Immunreaktion aus. Biosimilars bergen insgesamt ein geringes Risiko, aber aufgrund ihrer strukturellen Komplexität, ihrer Herstellungsmethode und ihres Immunogenitätsrisikos sind Regulierungsverfahren erforderlich.
Zu den Problemen/Einschränkungen bei Biosimilars gehört, dass die beiden Biosimilars unterschiedlichen Ursprungs sein können, dieselbe therapeutische Wirksamkeit haben und unterschiedliche Nebenwirkungen haben können, was umfangreiche Tests erforderlich macht. Der Ablauf des Patentschutzes für viele biologische Medikamente ist der Hauptantrieb für die Entwicklung von Biosimilar-Medikamenten. Aufgrund der Größe und Komplexität des Wirkstoffs sowie der Art des Herstellungsprozesses unterscheiden sich Biopharmazeutika von herkömmlichen Medikamenten mit kleinen Molekülen. Selbst geringfügige Änderungen im Prozess können zu tödlichen Folgen (der Prozess ist das Produkt) sowie zu Sicherheits- und Wirksamkeitsproblemen führen.
Das Ziel der FDA ist es, „die öffentliche Gesundheit zu schützen, indem die Sicherheit, Wirksamkeit und Zuverlässigkeit von Human- und Tierarzneimitteln, biologischen Produkten und medizinischen Geräten gewährleistet wird.“ Die FDA reguliert die Entwicklung von Biosimilars sorgfältig und jeder Antrag wird einer umfassenden Bewertung durch die Behörde unterzogen, die auf anderen, aber ebenso anspruchsvollen Anforderungen basiert wie das Referenzbiologikum. Daher können Patienten und verschreibende Ärzte die gleiche Qualität, Sicherheit und Wirksamkeit wie das Referenzbiologikum erwarten. Während sich die Entwicklung und behördliche Bewertung eines Referenzbiologikums im Allgemeinen auf klinische Daten der Phase III konzentriert, konzentriert sich die Entwicklung und Bewertung von Biosimilars hauptsächlich auf Vergleiche mit dem Referenzbiologikum, die am empfindlichsten sind, um Unterschiede festzustellen.
Die Entwicklung von Biosimilars ist in Bezug auf Zulassung, Herstellung und Marketing mit Komplexität verbunden und gehört damit zu den teuersten Entwicklungsvorhaben der Pharmaindustrie. Biosimilars werden wie Generika mit dem Ziel auf den Markt gebracht, die Gesundheitskosten zu senken. Die Markteinführung von Biosimilars ist jedoch mit höheren Kosten, größeren Risiken und einem höheren Zeit- und Fachaufwand für die klinische Entwicklung verbunden. Darüber hinaus erfordern Biosimilars einen anderen Marketing- und Markteinführungsansatz als niedermolekulare Generika. Die erheblichen Kosten für die Erlangung der FDA-Zulassung und den Aufbau der Produktionskapazität werden die Zahl der Biosimilar-Konkurrenten begrenzen.
In einer solchen Situation werden voraussichtlich nur wenige Biosimilar-Hersteller versuchen, mit einem bestimmten innovativen Medikament in den Markt einzusteigen, und sie werden ihre Arzneimittel wahrscheinlich nicht zu einem Preisnachlass von 10 bis 30 Prozent auf den Preis des innovativen Produkts anbieten. Da es außerdem keine automatische Substitution zwischen einem Biosimilar und einem Originalprodukt gibt, wird ein Biosimilar langsamer Marktanteile gewinnen. Daher ist es leicht zu verstehen, dass Art und Menge der für die Biosimilar-Forschung erforderlichen Ressourcen erhebliche Markteintrittsbarrieren darstellen können, nicht nur für kleine und mittelgroße Unternehmen, sondern auch für größere, etablierte Generikahersteller und multinationale Biopharmakonzerne. 85–87 Wenn es gegenüber dem Innovator keinen Zusatznutzen und nur geringe Kostensenkungen gibt, kann es schwierig sein, für ein Biosimilar Marktanteile zu gewinnen. Wenn viele Biosimilars auf den Markt gebracht werden, kann der Preis gesenkt werden.
Trotz der Ähnlichkeit von Biosimilars mit dem innovativen Medikament sollten sich Ärzte und medizinisches Personal einiger Bedenken bewusst sein, die während der Entwicklung und Zulassung dieser Medikamente aufgekommen sind und die die Grenzen der Biosimilars verdeutlichen. Die Verwendung von Biosimilars bringt eine Veränderung der klinischen Praxis mit sich. Die Pan American and Health Education Foundation ist aktiv an der Verbesserung der Patientensicherheit interessiert, indem sie eine wichtige Rolle bei der Aufklärung von Patienten und medizinischem Fachpersonal über die Gefahren und Vorteile von Biosimilars spielt.
Um die Sicherheit, Wirksamkeit und Qualität von Biosimilar-Produkten zu gewährleisten, wurde der FDA die Befugnis erteilt, Biosimilars, auch austauschbare, zu genehmigen. Die FDA ist befugt, einen „abgekürzten Weg“ für die Zulassung von Biologika zu überwachen, die „bioähnlich“ zu bereits zugelassenen Arzneimitteln sind, und zwar gemäß dem Biologics Price Competition and Innovation Act von 2009. Das verkürzte Verfahren wird unnötige und unethische Biosimilar-Tests an Tieren und Menschen minimieren. Dies spart Zeit, Geld und Personalressourcen. Dies wird auch durch den Patient Protection and Affordable Care Act von 2010 (USA) unterstützt. Die Einführung von Biosimilars erfordert eine sorgfältig ausgearbeitete Pharmakovigilanzstrategie.
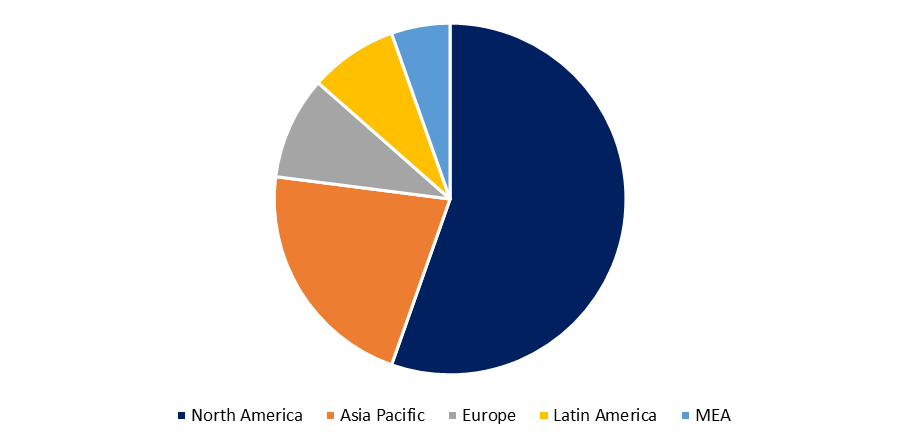
Biosimilars machen derzeit einen großen Teil des Pharmamarktes in den USA, Japan und Europa aus, da sie günstiger sind als biologische Medikamente. In Europa beispielsweise sind Biosimilars 30 Prozent günstiger als herkömmliche biologische Medikamente, wo 21 zugelassen wurden. Nur 18 % der Ärzte sind sich dieser Unterschiede bei biologischen Arzneimitteln bewusst. Da 66 US-Patente für biologische Medikamente zwischen 2022 und 2030 auslaufen und die FDA im Jahr 2021 mehr Biosimilar-Anträge prüfen wird, steht das Biosimilar-Geschäft kurz vor einem großen Aufschwung und erschließt neue Märkte. Darüber hinaus wird der Patent-Cliff, mit dem diese Arzneimittel konfrontiert sind, zu jährlichen Medikamentenverkäufen in Milliardenhöhe führen. Da die USA und Japan am meisten für Biologika ausgeben, wird erwartet, dass sie die größten und wichtigsten Biosimilar-Marktzentren werden. Schätzungen zufolge werden patentfreie Arzneimittel bis 2021 mindestens die Hälfte des Marktes ausmachen, was enorme Wachstumschancen für Biosimilars bietet.
Erfahren Sie mehr über diesen Bericht -
Das erste Biosimilar wurde 2015 in den USA zugelassen. Da 12 Patente für Biologika im Jahr 2020 auslaufen, werden Biosimilars wahrscheinlich das Geschäft mit Biologika auf wettbewerbsintensive Weise übernehmen. Darüber hinaus wird erwartet, dass Biosimilars bis 2021 4 bis 10 % des Biologikamarktes ausmachen werden. Das bislang erfolgreichste US-Biosimilar (Zarxio) hat über 55 % des Filgrastimmarktes in den USA erobert (Hagen, 2020). Biosimilars hingegen werden in den USA nur langsam akzeptiert. Einer neuen Überprüfung der Entscheidungen der größten privaten US-Krankenversicherungen zur Kostendeckung von Biosimilars zufolge gewährten nur 14 % dieser Entscheidungen Biosimilars eine bevorzugte Kostendeckung (Chambers et al., 2020). Obwohl Europa allgemein eine deutlich höhere Verbreitung von Biosimilars zugeschrieben wird, in manchen Fällen bis zu 100 %, wird seine Dominanz in diesem Sektor häufig übertrieben. Während einige europäische Länder in bestimmten Therapiebereichen einen großen Marktanteil an Biosimilars haben, variiert die Verbreitung von Biosimilars in Europa und je nach Produktklasse stark (IQVIA, 2019b).
Im Jahr 2018 verwendeten 16 europäische Länder mehr als 90 % der Filgrastim- und Pegfilgrastim-Biosimilars, in Irland jedoch nur 27 % der Filgrastim- und Pegfilgrastim-Biosimilars (IQVIA, 2019b). Norwegen und Dänemark verzeichneten mit 81 % bzw. 96 % die höchste Verbreitung von Anti-Tumornekrosefaktor-Biosimilars (Adalimumab, Etanercept und Infliximab), während alle anderen Länder weniger als 50 % verwendeten (IQVIA, 2019b).
Segmentierung
Nach Produkt
- Rekombinantes menschliches Wachstumshormon (RHGH)
- Granulozyten-Kolonie-stimulierender Faktor
- Interferon
- Sonstiges
Nach Produktionstyp
- Eigene Fertigung
- Auftragsfertigung
Nach Technologie
- Rekombinante DNA
- Monoklonale Antikörper
Nach Anwendung
- Off-Site-Verarbeitung
- Onkologie
- Chronische Krankheiten
- Autoimmunerkrankungen
- Sonstiges
Nach Region
- Nordamerika – Vereinigte Staaten, Mexiko, Kanada
- Europa – Großbritannien, Frankreich, Deutschland, Italien, Spanien und Rest von Europa
- Asien-Pazifik – China, Japan, Indien, Korea und Rest des Asien-Pazifik-Raums
- Südamerika – Brasilien, Argentinien, Kolumbien, Rest von Südamerika
- Naher Osten und Afrika – GCC, Südafrika, Rest des Nahen Ostens und Afrikas
Benötigen Sie Hilfe, um diesen Bericht zu kaufen?